في خطوة مثيرة، طور علماء أول علاج محتمل يمكنه إصلاح الحاجز الدموي الدماغي لدى الفئران.
وفي حين لم يتم اختبار العلاج الجديد على البشر حتى الآن، إلّا ان العثور على طريقة لمنع مسببات الأمراض والسموم من التسلل لخلايا الدماغ يمكن أن يغير الطريقة التي نعالج بها ونمنع الحالات الطبية بما في ذلك السكتات الدماغية والسرطان وفيروس كورونا الطويل ومرض ألزهايمر.
والحاجز الدموي الدماغي عبارة عن طبقة من الخلايا المحيطة بالأوعية الدموية التي تغذي أدمغتنا. من المفترض أن تكون غير قابلة للاختراق بشكل انتقائي، ما يعني أنها تسمح فقط للمواد المطلوبة للحفاظ على عمل الدماغ السليم بالمرور إلى أنسجة المخ الثمينة. لكن عندما لا تعمل الأشياء بشكل صحيح، يمكن للسموم أو الخلايا أو مسببات الأمراض غير المرغوب فيها اختراق الحاجز. حيث يمكن أن تتحول الخلايا السرطانية التي تتجاوز الحاجز إلى أورام. فقد ثبت أن SARS-Cov-2 يخترق الحاجز ويسبب ضبابًا في الدماغ؛ ويمكن أن يؤدي دخول الكثير من خلايا الدم البيضاء إلى أمراض المناعة الذاتية مثل التصلب المتعدد؛ وهذا على سبيل المثال لا الحصر من المضاعفات. إنه يمثل تحديًا كبيرًا بالنسبة لنا للحصول على الأدوية من خلال الحاجز الدموي الدماغي. لكن إيجاد طريقة لإيقاف هذا التسرب أمر استعصى على العلماء حتى الآن.
لذلك يقول اختصاصي أمراض الدم كالفن كو بجامعة ستانفورد «إن الحاجز الدموي الدماغي المتسرب هو مسار شائع للعديد من أمراض الدماغ. لذا فإن القدرة على سد الحاجز كان هدفًا مرغوبًا منذ فترة طويلة في الطب. من أجل ذلك «قمنا بتقييم فئة علاجية جديدة من الجزيئات التي يمكن استخدامها لعلاج تسرب الدم في الدماغ الحاجز؛ ففي السابق لم تكن هناك علاجات موجهة إلى الحاجز الدموي الدماغي على وجه التحديد»، وذلك وفق ما نقل موقع «ساينس إليرت» العلمي المتخصص عن مجلة «Nature Communications» العلمية.
ويتركز عمل الباحثين على عائلة من المستقبلات تسمى«frizzled»؛ إذ تبدأ هذه البروتينات مسار إشارات Wnt، والذي لا يشارك فقط في تعزيز تجديد الأنسجة والتئام الجروح فحسب؛ بل انه مهم أيضًا للحفاظ على حاجز دموي صحي.
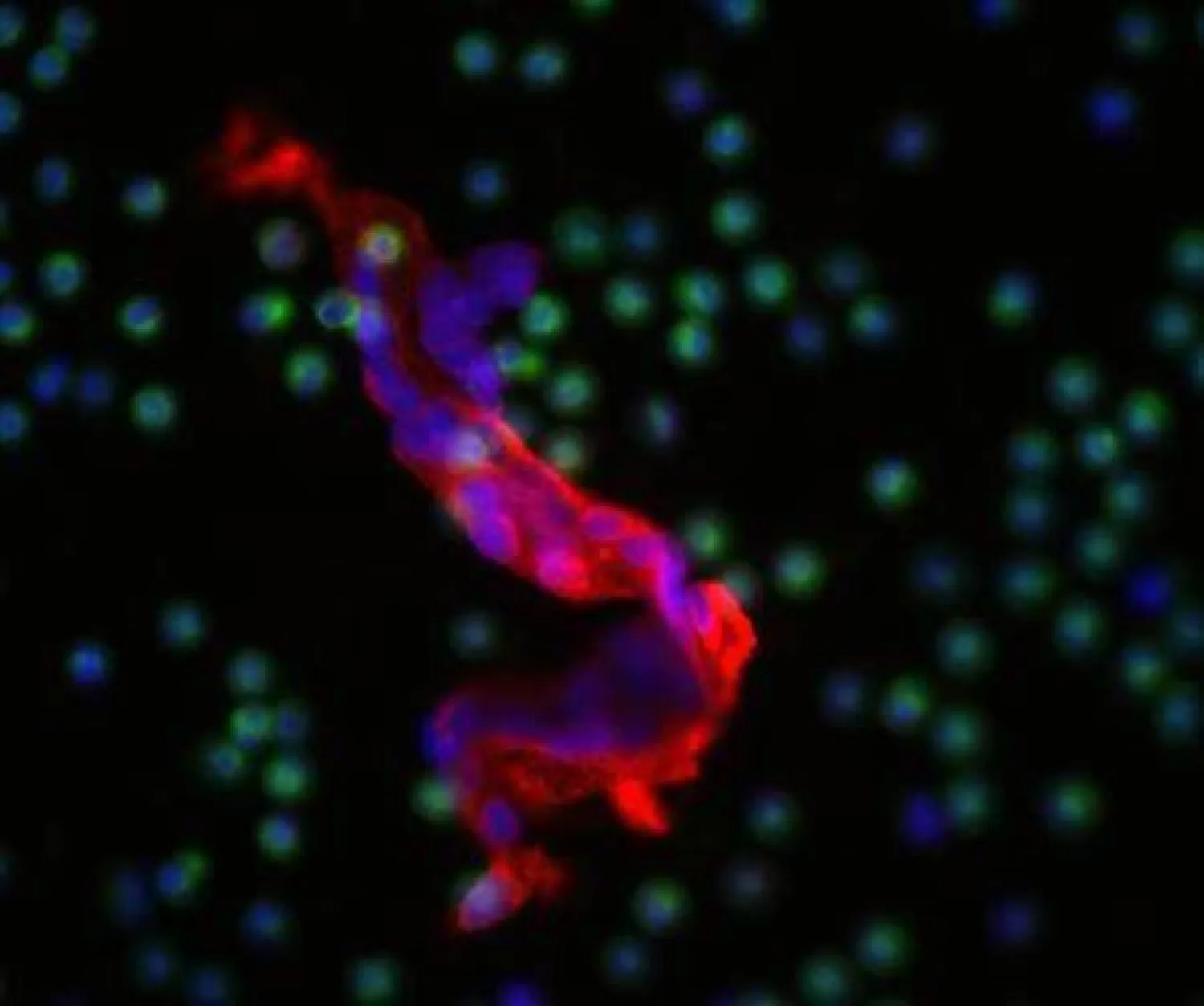
وفي هذا الاطار، أظهرت الأبحاث السابقة التي أجريت على الفئران أن الطفرات في الجين المجعد يمكن أن تسبب مشاكل في الحاجز الدموي الدماغي، خاصةً أحد المستقبلات المجعدة التي تسمى FZD4. وبناءً على هذا العمل، تعاون فريق ستانفورد مع شركة أبحاث لإنشاء جزيء يسمى «L6-F4-2» يرتبط بـ«FZD4» لتنشيط إشارات Wnt. حيث انه ينشط مسار Wnt بكفاءة 100 مرة أكثر من الجزيئات الأخرى المعروفة بأنها مرتبطة بـ FZD4.
ولاختبار العلاج الجديد المحتمل بشكل أكبر، نظر الباحثون في الفئران ذات الطفرات الجينية التي تسبب حالة مشابهة لمرض نوري (اضطراب وراثي يؤثر بالدرجة الأولى على العين ويؤدي في أغلب الأحيان إلى العمى. بالإضافة إلى تشوهات العين الخَلقِية وغيرها). تمنع الطفرة الفئران من صنع Norrin؛ وهو بروتين يرتبط بـ FZD4. وتعاني الفئران التي لا تحتوي على Norrin من العمى بسبب مشاكل في الحاجز الدموي الشبكي في العين؛ والذي يعمل بطريقة مشابهة للحاجز الدموي الدماغي. ولكن عندما قام الفريق بحقن إحدى عيون كل فأر بـ L6-F4-2 عند الولادة، كانت الأوعية الدموية حول الشبكية أكثر كثافة وأقل تسريبًا من العين التي لم يتم علاجها. جدير بالذكر، كشفت دراسات أخرى أجريت على الفئران الأكبر سنًا أن L6-F4-2 قد نجح بتنشيط إشارات Wnt في كل من شبكية العين والمخيخ.
ثم درس الباحثون حالة أكثر شيوعًا هي (السكتة الدماغية)؛ والتي تنطوي على تلف الحاجز الدموي الدماغي. L6-F4-2 الذي يُعطى للفئران المصابة بسكتات دماغية، فقلل من شدة السكتة الدماغية وحسّن البقاء على قيد الحياة مقارنة بالفئران التي لم تعالج من السكتات الدماغية. لكن الأكثر إثارة هو أن L6-F4-2 بدا أيضًا أنه يعكس تسرب الأوعية الدموية في الدماغ بعد السكتة الدماغية الإقفارية في الفئران.
ويعمل الفريق الآن على ما إذا كان من الممكن استخدام L6-F4-2، أو جزيء مشابه، لإنتاج أدوية يمكن تجربتها يومًا ما على البشر.
ويخلص كو الى القول «نأمل أن تكون هذه الخطوة هي الأولى نحو تطوير جيل جديد من الأدوية يمكنها إصلاح الحاجز الدموي الدماغي باستخدام استراتيجية مختلفة تمامًا عن الأدوية الحالية».