لطالما كان علاج السرطان يقوم على قتل الأورام والحفاظ على الجسم ووظائفه الرئيسية، ولطالما كان العلاج الكيميائي لفترة طويلة خط الدفاع الأول في مواجهة هذا المرض، إلا أن آثاره الجانبية، وفي بعض الأحيان مقاومة الجسد له وفشله في العلاج، جعلت منه خياراً مكلفاً. وفي البحث عن طرق أكثر أماناً وذكاءً في استهداف السرطان والخلايا الخبيثة، برز ابتكار جديد من شأنه تغيير المعادلة.
في جوهر هذا الابتكار، مادة ذات استخدام شائع في المجوهرات والدوائر الكهربائية، ألا وهي البلاتين. لعقود طويلة، استُخدمت أدوية قائمة على البلاتين، مثل سيسبلاتين وأوكساليبلاتين، لعلاج أنواع مختلفة من السرطان؛ كون هذه الأدوية تعمل عن طريق الارتباط بالحمض النووي، وتثبيط انقسام الخلايا، ما يُحفز موت الخلايا المبرمج. ولكن مركبات البلاتين التقليدية ليست خالية من العيوب، فهي بطيئة المفعول، وغالباً ما تكون سامة للخلايا السليمة، وتواجه مقاومة متزايدة من الأورام نفسها التي صُممت لتدميرها.
وقد تمكّن فريق بقيادة الدكتورة جون هوا ماي، أستاذة مساعدة في أبحاث الطب النانوي في قسم أبحاث الطب النانوي بمستشفى هيوستن ميثوديست، من اكتشاف تركيبة بلاتينية جديدة، تُسخّر قوة أنواع الأكسجين التفاعلية لقتل الخلايا السرطانية.
وأجرى الفريق بحثاً شاملاً حول كيفية تأثير المعادن المختلفة على إنتاج أنواع الأكسجين التفاعلية، ووجد أن العديد من مركبات البلاتين أنتجت أعلى مستويات من أنواع الأكسجين التفاعلية داخل الخلايا، مقارنةً بالمعادن الأخرى المُختبَرة.
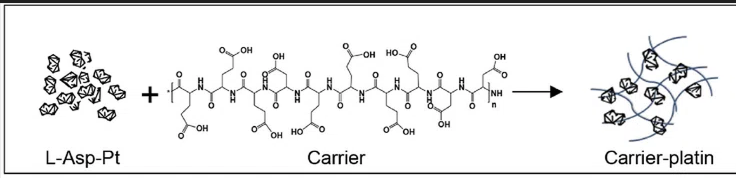
وفي دراسة نُشرت في مجلة «بايوماتيرليز»، كشف الفريق عن مادة نانوية جديدة مصنوعة من البلاتين تُسمى «البلاتين الحامل»، تستخدم أنواع الأكسجين التفاعلية، تحديداً جذور الهيدروكسيل، التي تُعد من أكثر الجزيئات ضرراً في علم الأحياء، لتحفيز موت الخلايا السرطانية بسرعة ودقة ملحوظتين.
وخلافاً للعلاج الكيميائي التقليدي الذي يستغرق ساعات أو أياماً كي يبدأ مفعوله، فإن البلاتين الحامل يعمل خلال دقائق، ويكمن السر في تكوينه.
ويوضح الدكتور يونغ بين لو، باحث مشارك في الطب النانوي، والمؤلف الأول للدراسة، أن على المستوى الجزيئي، البلاتين الحامل هو مركّب هندسي نانوي مكون من جسيمات البلاتين النانوية المُضمَّنة في حامل بوليمر قابل للتحلل الحيوي. ويشرح دكتور لو أن هذا الحامل لا يُوفر بنيةً فحسب، بل يُحسِّن البيئة الكيميائية المحيطة بالبلاتين، ما يُعزز بشكل كبير قدرته على تحفيز تحلل بيروكسيد الهيدروجين، المُتوفر طبيعياً في الخلايا السرطانية.
وينتج هذا التفاعل التحفيزي جذور الهيدروكسيل في دفعات شديدة للغاية؛ تُربك توازن الأكسدة والاختزال الهش بطبيعته في الخلايا السرطانية. ما ينتج عنه موت خلوي نخري سريع، غير مبرمج وانتقائي بشكل لافت للخلايا الخبيثة.
وعند اختباره على سلالات خلايا سرطان القولون، والمستقيم، والثدي، والمبيض، والرئة، والكلى، بما في ذلك تلك المقاومة للعلاج الكيميائي التقليدي، وجّه البلاتين الحامل ضربةً قاضية ومدمرة، إذ ارتفعت مستويات أنواع الأكسجين التفاعلية بمقدار 30 ضعفاً خلال 30 دقيقة من العلاج، وهو إنجازٌ لا يُضاهيه حتى أقوى العلاجات المستخدمة حالياً، والمُولّدة لأنواع الأكسجين التفاعلية.
وفي الوقت نفسه، نجت الخلايا غير السرطانية إلى حد كبير. ويرجع ذلك إلى احتواء الخلايا السليمة على مستويات أعلى من الجلوتاثيون ومستوى أقل من الماء، ما يحميها من أنواع الأكسجين التفاعلية. ولكن الإيجابيات لا تتوقف على سلامة الخلايا غير السرطانية. فمن أكثر المشكلات تعقيداً في علم الأورام، هو قدرة بعض الأورام الخبيثة على مقاومة الأدوية؛ حيث تتكيف الخلايا السرطانية وتنجو، وفي النهاية تتفوق على أفضل أدواتنا الدوائية، إلا أن البلاتين الحامل يكسر هذا النمط.
تقول الدكتورة جون هوا ماي: «على الرغم من تعرضها مراراً للبلاتين الحامل على مدار أسابيع، لم تُطور خلايا الورم أي مقاومة. في المقابل، أصبحت سلالات الخلايا نفسها مقاومة للأوكساليبلاتين. بالإضافة إلى ذلك، احتفظ البلاتين الحامل بكامل فاعليته في الخلايا، التي أصبحت بالفعل مقاومة للسيسبلاتين والتاكسانات والأدوية الأخرى».
وأضافت الدراسات التي أُجريت على نماذج الفئران، بُعداً جديداً من التفاؤل، ففي الأورام العدوانية، بما فيها تلك المقاومة لأدوية البلاتين، أوقف البلاتين الناقل نمو الورم، وفي كثير من الحالات، قضى عليه تماماً. وحتى عند الجرعات العالية، أظهرت التركيبة سمية ضئيلة.
ويُعزى هذا التباين في السلامة جزئياً إلى الناقل البوليمري، الذي يُثبّت الدواء، ويُساعد على تقييد نشاطه في بيئة الورم الحمضية الغنية بأنواع الأكسجين التفاعلية.
وتظهر الدراسات اختلاف آلية الموت التي يُحدثها البلاتين الحامل، عن تلك التي تحصل في العلاجات الكيميائية التقليدية، فبدلاً من تحفيز موت الخلايا المبرمج، الذي يتضمن انكماش الخلايا وتفتت الحمض النووي، ينخر البلاتين الحامل الخلايا السرطانية، عبر نفاذية غشاء الليزوزوم وإجهاد الشبكة الإندوبلازمية، وهما سمتان مُميزتان لإصابة الخلايا بالتأكسدية الساحقة.
وعلى الرغم من اشتراك آلية ناقل البلاتين في بعض خصائص موت الخلايا الحديدي، وهو مسار آخر لموت الخلايا يعتمد على أنواع الأكسجين التفاعلية، فإنها فريدة من نوعها، فتأثيراتها لا تعتمد على الحديد، وسريعة جداً، بحيث لا تتوافق مع مسار موت الخلايا الحديدي الأبطأ، الذي يعتمد على بيروكسيد الدهون.
وعلى الرغم من جميع هذه الإيجابيات، تُطرح أسئلة حول الخصائص الهيكلية الدقيقة لجسيمات البلاتين النانوية، التي تُمكّن من هذا التحفيز الفعال، وما إذا كان من الممكن تصميم هذا النهج ليناسب أنواعاً مختلفة من الأورام، أو دمجه مع العلاجات المناعية. لكن هناك أمراً واحداً واضحاً: يُمثل البلاتين الحامل نقلة نوعية، فبدلاً من مجرد تسميم الخلايا السرطانية، فإنه يُسخّر نقاط ضعفها الأيضية بصفته سلاحاً، محولاً إجهادها التأكسدي إلى نقطة ضعف قاتلة.
وتختم الدكتورة جون هوا ماي: «قد يُفضي هذا البحث إلى علاجات جديدة، تُعطي أملاً للمرضى الذين يُعانون أورام مقاومة للأدوية، وللأطباء الذين نفدت خياراتهم في علاج السرطان».