في إحدى غرف الأبحاث الهادئة في جامعة «يونيفرسيتي كوليدج-لندن» (UCL)، جلس البروفيسور وسيم قاسم، أحد أبرز روّاد العلاج الجيني والعلاج الخلوي في أوروبا، يستعيد قصة بدأت بصراعٍ غير متكافئ بين طفلة رضيعة ومرضٍ شرس.
سرطان دم عدواني
قبل سنوات، كانت طفلة بريطانية لم تتجاوز عامها الأول تُواجه أحد أكثر أنواع سرطان الدم عدوانية، بعد أن فشلت العلاجات التقليدية، وضاقت الخيارات الطبية إلى حدّها الأقصى. أما اليوم، وبعد رحلة علمية دقيقة وطويلة، فإن هذه الطفلة تعيش، وقد بلغت السادسة عشرة، حياة طبيعية خالية من المرض، بفضل علاج خلوي متقدّم قائم على تعديل الجينات، طوّره فريق البروفيسور قاسم في مستشفى «غريت أورموند ستريت» بالتعاون مع الجامعة.
ليست هذه حكاية انتصارٍ درامي بقدر ما هي شهادة على تحوّل عميق في الطب الحديث: حين لا يعود العلاج مجرّد مواجهة مع المرض، بل محاولة لفهمه وإعادة توجيه جهاز المناعة نفسه ليقوم بالمهمة.

علاج خلوي معدَّل جينياً
وفي مقابلة حصرية مع الشرق الأوسط يقول البروفيسور قاسم بهدوء العالم الذي يعرف حدود العلم بقدر ما يعرف قوّته: «العلاج الخلوي المعدَّل جينياً لم يعد طبّ المستقبل، بل أصبح واقعاً حاضراً لبعض أنواع السرطان»... إنه نافذة على زمنٍ جديد، يُدار فيه الصراع مع المرض داخل الخلية... لا خارجها.
تقنية تحرير الجينوم
لنبدأ من اللحظة الأولى... كيف اتُّخذ القرار باستخدام تقنية تحرير الجينوم لعلاج هذه الطفلة؟
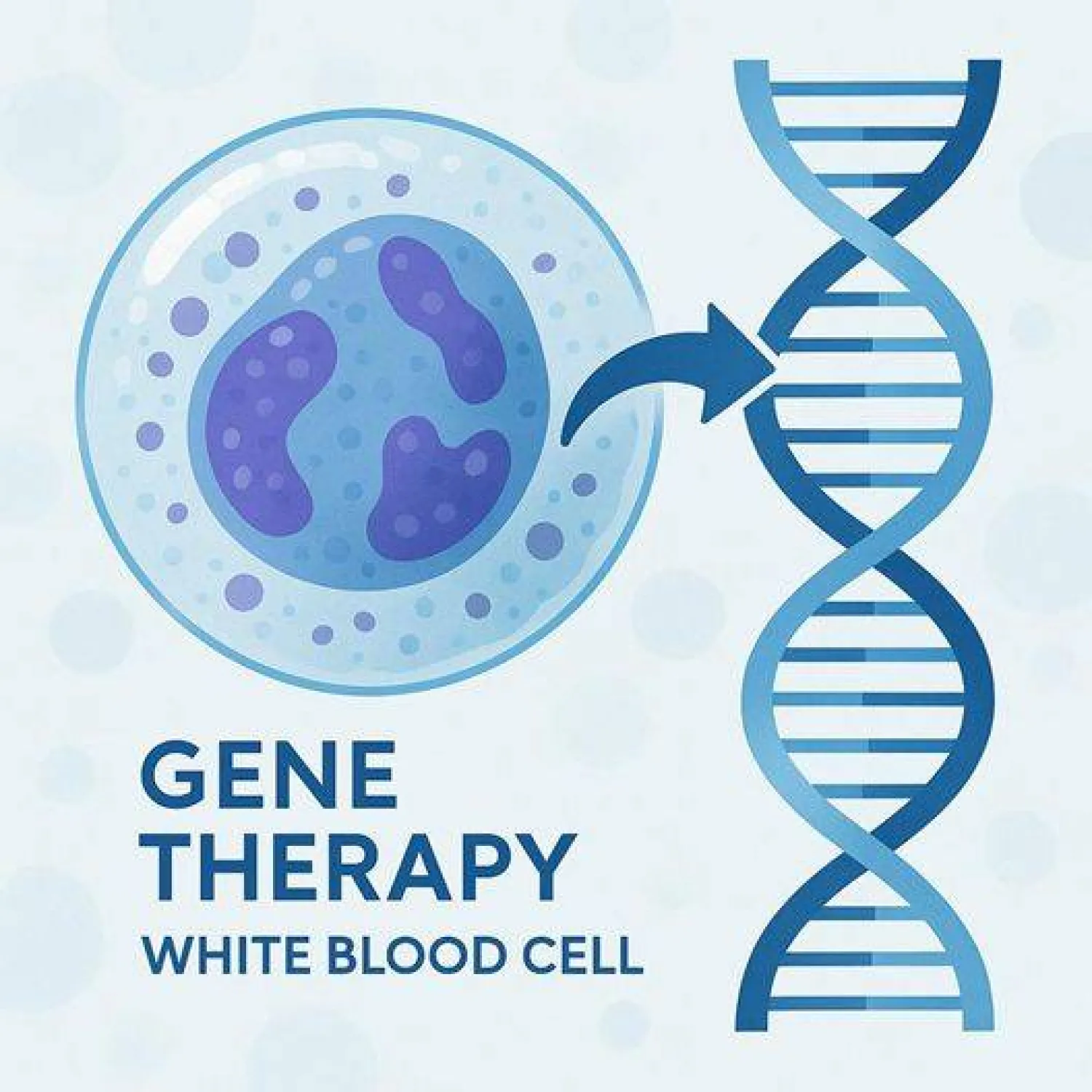
- كانت الحالة بالغة التعقيد. الطفلة لم تستجب لأي من العلاجات التقليدية المتاحة، وكانت قد استنفدت معظم الخيارات الطبية، فيما كان عامل الوقت يضغط بقسوة. في تلك المرحلة، كنا نعمل منذ سنوات على تطوير خلايا مناعية تُعرف بـ«الخلايا التائية» (T cells)، يجري تعديلها جينياً داخل المختبر، وهي ما يُعرف بعلاج CAR-T، بحيث تفقد قدرتها على مهاجمة أنسجة المريض، وتكتسب في المقابل دقة عالية في استهداف الخلايا السرطانية وحدها.
بعد نقاشات علمية معمّقة، ومراجعات أخلاقية صارمة، وموافقات تنظيمية دقيقة، تقرر إدخال هذه الحالة ضمن التجربة العلاجية. لم يكن القرار سهلاً بأي حال، لكنه -في ذلك التوقيت- كان الفرصة الوحيدة المتاحة لإنقاذ حياة الطفلة.
* ما التقنية الدقيقة التي استخدمتموها في هذا العلاج؟
- اعتمدنا على «الخلايا التائية» التي جرى تعديلها جينياً داخل المختبر لتؤدي وظيفة علاجية محددة. وقد شمل هذا التعديل ثلاث خطوات رئيسية:
. تعطيل مستقبل يُسمّى «TCR»، وهو المفتاح الذي قد يدفع الخلية المناعية إلى مهاجمة جسم المريض نفسه، وذلك لتجنّب أي ردّ فعل مناعي ضار.
. تعطيل جين «CD52»، بهدف جعل الخلايا المعدّلة قادرة على تحمّل الأدوية التي تُستخدم لتهيئة جسم المريض قبل العلاج.
. إضافة مستقبل ذكي يُعرف بـ«CAR»، يعمل بوصفه جهاز توجيه يسمح للخلايا المناعية بالتعرّف بدقة على خلايا سرطان الدم (اللوكيميا) ومهاجمتها فقط.

جراحة دقيقة داخل الشفرة الوراثية
بهذا المعنى، كانت العملية أشبه بجراحة دقيقة داخل الشفرة الوراثية للخلية، جراحة لم تستهدف المرض فحسب، بل أعادت تدريب جهاز المناعة على أداء مهمته... ونجحت في إنقاذ حياة.
* هل يمكن اعتبار هذه الحالة من أوائل حالات الشفاء طويل المدى باستخدام تعديل الجينات في بريطانيا؟
-نعم، تُعدّ من أوائل الحالات على مستوى بريطانيا، ومن الحالات المبكرة عالمياً في هذا المجال. والأهم من ذلك أنها لا تزال، بعد مرور ستة عشر عاماً، خالية تماماً من المرض، وهو ما يمنحنا مؤشراً إيجابياً على استدامة هذا النوع من العلاج عند تطبيقه بدقة وفي إطار تجارب سريرية محكومة.
* هل يمكن أن يصبح تحرير الجينات بديلاً عن العلاج الكيميائي في المستقبل؟
- نحن نتجه في هذا المسار، لكن بحذر. حتى الآن، يُستخدم تعديل الجينات بشكل أساسي في بعض سرطانات الدم، وليس في جميع أنواع السرطان. ولا يزال الطريق طويلاً قبل أن يصبح هذا النهج بديلاً واسع الانتشار.
لكن من الممكن، خلال العقد المقبل، أن تتحول بعض علاجات اللوكيميا إلى علاجات روتينية تعتمد على إعادة برمجة الجهاز المناعي، بدل الاعتماد الكامل على العلاج الكيماوي أو الإشعاعي.
جدل أخلاقي
* ماذا عن الجدل الأخلاقي المحيط بتعديل الجينات؟
- الأخلاقيات ليست جانباً ثانوياً في عملنا، بل هي في صميمه. ما نقوم به يقتصر على تعديل خلايا الدم البيضاء فقط بهدف علاج المرض، ولا يمسّ جوهر الإنسان أو صفاته الوراثية. هذه التعديلات علاجية ومؤقتة، ولا يمكن أن تنتقل إلى الأبناء.
من المهم التأكيد أن تحرير الجينوم يُستخدم هنا بوصفه أداة طبية دقيقة، لا وسيلة لتحسين الصفات أو تغيير الطبيعة البشرية. كما أنه لا توجد، في الوقت الراهن، حاجة علمية إلى تحرير الجينات الوراثية للأجنة، إذ يمكن في معظم الحالات تفادي الأمراض الوراثية بوسائل طبية أخرى أكثر أماناً.
التعاون مع العالم العربي
* يشهد العالم العربي، ولا سيما المملكة العربية السعودية، تطوراً متسارعاً في مجالات الطب الدقيق. هل ترون آفاقاً للتعاون في هذا المجال؟
-بلا شك. تشهد المملكة العربية السعودية تقدماً ملحوظاً في مجالات الطب الدقيق والبحوث الجينية، وهناك فرص حقيقية للتعاون العلمي والطبي. ويمكن أن يشمل هذا التعاون تدريب الكوادر الطبية على تقنيات العلاج الخلوي والجيني، وتطوير مراكز متخصصة للعلاجات المتقدمة، إلى جانب إطلاق برامج بحثية مشتركة تُعنى بأمراض منتشرة في المنطقة. وأرحّب شخصياً بأي فرصة للحوار والتعاون العلمي في هذا المجال.
وأخيراً
* ماذا تقول لطفلة تمر اليوم بتجربة مشابهة؟
-أقول لها إن الخوف مفهوم، لكن العلم اليوم يملك أدوات أقوى مما كان عليه في الماضي. هناك فرق طبية وعلمية تعمل بصبر ودقة، هدفها أن تمنح المرضى أفضل فرصة ممكنة للعلاج. وهي ليست وحدها في هذه الرحلة.
يعكس هذا الحوار ملامح مرحلة جديدة في الطب الحديث، مرحلة لا تكتفي بمواجهة المرض بأدواته التقليدية، بل تسعى إلى فهمه على مستوى الخلية وإعادة توجيه آليات الجسم نفسه لمقاومته.
والطفلة التي تعافت من سرطان الدم، وأصبحت اليوم شابة في السادسة عشرة، لا تمثل حالة فردية فحسب، بل مثالاً على ما يمكن أن يحققه التقدم العلمي حين يُطبَّق بدقة، وبحذر، وضمن أطر أخلاقية صارمة.