قال الطبيب والفيلسوف أبو بكر الرازي، قبل أكثر من ألف عام: «لا ينبغي للطبيب أن ييأس من شفاء مريض، فربما كان في الجسم قوى خفية لم تُستنهَض بعد».
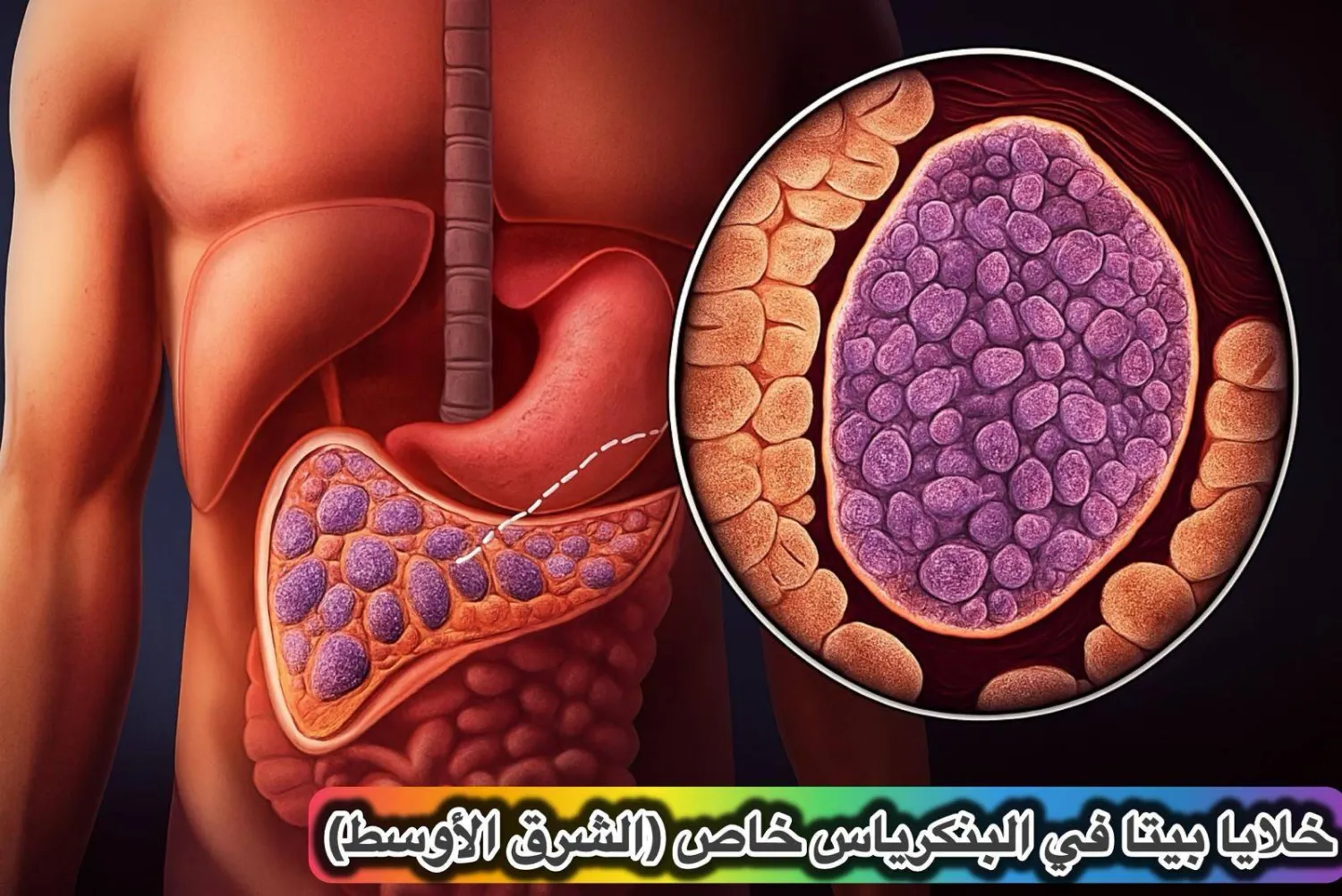
إحياء خلايا الإنسولين الخامدة
واليوم، تُثبت البحوث الحديثة أن في الجسد أسراراً لم نكشفها بعد. ففي خطوة علمية فارقة قد تعيد الأمل لملايين المصابين حول العالم، تمكن فريق دولي من إحياء خلايا الإنسولين البشرية (Beta cells) التي خمدت في داء السكري من النوع الثاني، لتستعيد قدرتها المذهلة على إنتاج الإنسولين من جديد؛ وكأنها استيقظت من سبات طويل.
الدراسة التي نُشرت في مجلة «ساينس أدفانسز» (Science Advances) بتاريخ 4 أكتوبر (تشرين الأول) 2025، بعنوان «الاستعادة الوظيفية لخلايا (بيتا) الجزرية في داء السكري من النوع الثاني»، قدَّمت برهاناً علمياً قوياً على أن الضرر الذي يصيب هذه الخلايا ليس دائماً؛ بل يمكن عكسه جزئياً إذا أعيدت تهيئة البيئة المحيطة بها.
إنه تحوُّل جذري في نظرتنا للمرض: من محاولة السيطرة على الأعراض، إلى إمكانية عكس مساره من جذوره.

تحالف علمي أوروبي
جاء هذا الاكتشاف اللافت ثمرة تعاون علمي بين ثلاث مؤسسات أوروبية مرموقة، هي «جامعة بيزا» (University of Pisa) في إيطاليا، و«جامعة بروكسل الحرة» (Université Libre de Bruxelles) في بلجيكا، و«المعهد السويسري للمعلوماتية البيولوجية» (Swiss Institute of Bioinformatics) في سويسرا. وضم الفريق البحثي نخبة من العلماء المرموقين، من بينهم البروفسورة مارا سليمان (Prof. Mara Suleiman) المتخصصة في بيولوجيا خلايا البنكرياس، والبروفسورة ميريام كنوب (Prof. Miriam Cnop) من «جامعة بروكسل الحرة»، وهي من أبرز الأسماء في بحوث داء السكري على المستوى الأوروبي، والبروفسور بييرو ماركيتي (Prof. Piero Marchetti) من «جامعة بيزا»، وهو من رواد بحوث جزر البنكرياس البشرية، والبروفسور فريدريك بوردِه (Prof. Frédéric Burdet) من «المعهد السويسري للمعلوماتية البيولوجية»، إلى جانب مساهمات من باحثين آخرين من دول أوروبية عدة. ويعكس هذا التحالف العلمي النهج المتصاعد نحو بحوث متعددة التخصصات، تجمع بين الطب الإكلينيكي، والبيولوجيا الجزيئية، وتحليل البيانات الحيوية، من أجل التصدي للأمراض المزمنة المعقدة بطرق مبتكرة، تتجاوز حدود التخصص الواحد.
خلايا مرهَقة... لا ميتة
لطالما ارتبط النوع الثاني من داء السكري بفكرة الانحدار البطيء والنهائي لوظيفة خلايا «بيتا» المنتجة للإنسولين في البنكرياس. ففي هذا النوع من السكري، لا يختفي الإنسولين من الجسم كما يحدث في النوع الأول؛ بل تبدأ هذه الخلايا بالدخول في دوامة من الإرهاق المزمن نتيجة الارتفاع المستمر في مستويات السكر والدهون، إضافة إلى التأثيرات الخفية للالتهابات المتكررة على الأنسجة الدقيقة للبنكرياس. إنها ليست لحظة انهيار مفاجئ؛ بل هو مسار طويل من الإنهاك الصامت، تُستنزف فيه الخلايا يوماً بعد يوم، حتى تفقد قدرتها على مجاراة احتياجات الجسم المتزايدة من الإنسولين.
ومع مرور الوقت، يتراجع إنتاج الإنسولين تدريجياً، ويختل التوازن الدقيق بين العرض والطلب داخل الجسم. وتصبح الخلايا أشبه بعمَّال مصنع يعملون ليل نهار دون راحة؛ في البداية يواصلون الإنتاج رغم الإرهاق، ثم يبدأ الأداء في التراجع شيئاً فشيئاً، حتى يخفت النشاط ويعمَّ الصمت، ويبدو للوهلة الأولى وكأن المصنع قد أغلق أبوابه إلى الأبد.
كيان في حالة سكون بيولوجي
لكن الدراسة الأخيرة جاءت لتقلب هذه الصورة التقليدية رأساً على عقب. فهي لم تتعامل مع خلايا «بيتا» بوصفها خلايا «ميتة» فقدت وظيفتها نهائياً؛ بل نظرت إليها ككيان حي دخل في حالة سكون بيولوجي قابلة للعكس. هذا التحول في الفهم يشبه الانتقال من مشهد «نهاية» إلى مشهد «سبات عميق» يمكن أن يعقبه استيقاظ.
هذه الفرضية البسيطة في ظاهرها عميقة في دلالتها؛ فهي تفتح الباب أمام تصور علاجات لا تكتفي بكبح المرض أو الحد من مضاعفاته؛ بل تستهدف إحياء الخلايا من الداخل، وإعادة تفعيل طاقتها الكامنة. لم يعد الهدف -فقط- السيطرة على مستويات السكر بالأدوية؛ بل استعادة «النبض البيولوجي» الذي خبا داخل البنكرياس، ليعود الجسم إلى توازنه الطبيعي كما كان قبل المرض.
صحوة في المختبر
في خطوة علمية أشبه بمشهد سينمائي داخل أنبوب اختبار، قرر الفريق البحثي أن يضع فرضيته موضع التجربة الفعلية. فقد جمع العلماء جزر بنكرياس بشرية من 19 متبرعاً مصابين بالنوع الثاني من السكري، وهي العينات التي تمثل بيئة خلوية مثقلة بسنوات من الإجهاد الأيضي (كلمة «أيضي» تعني العمليات الحيوية التي تقوم بها خلايا الجسم لتحويل الطعام إلى طاقة والحفاظ على وظائفه الأساسية) وارتفاع مستويات السكر والدهون. ثم جرى نقل هذه الخلايا بعناية إلى بيئة مخبرية نقية، خالية من الضغوط الالتهابية والتمثيلية التي كانت تُنهكها داخل الجسم، ليمنحوها فرصة للتنفس من جديد.

خلال ساعات وأيام قليلة، بدأت الخلايا تُظهر إشارات غير متوقعة؛ فقد بدت وكأنها تستيقظ ببطء من سبات طويل. استعاد عدد كبير منها قدرته على الاستجابة للغلوكوز وإفراز الإنسولين بصورة أقرب إلى الخلايا السليمة، وهو ما لم يكن متوقعاً لخلايا كانت تبدو خامدة تماماً. وهذا المشهد أشبه بمصنع قديم توقفت آلاته عن الدوران، ثم ما إن أُزيل عنها الغبار وزُوِّدت بالطاقة حتى عادت تنبض بالحياة شيئاً فشيئاً.
هذه النتيجة لم تكن مجرد تفصيل تجريبي عابر؛ بل رسالة قوية مفادها أن خلايا «بيتا» ليست ضحية نهائية للمرض؛ بل يمكن أن تُمنح فرصة ثانية إذا وُضعت في الظروف المناسبة. لقد كشف المختبر عن وجه آخر للمرض؛ وجه لا يقوم على الانهيار الكامل؛ بل على السكون القابل للإحياء.
دواء قديم بدور جديد
من بين أكثر النتائج إثارة للاهتمام في هذه الدراسة، أن الباحثين لجأوا إلى «الميتفورمين» (Metformin)، ذلك الدواء الكلاسيكي الذي يُوصف منذ أكثر من ستين عاماً لمرضى السكري، والذي طالما ارتبط في أذهان الأطباء والمرضى بدور «مساعد» في خفض السكر، وتحسين حساسية الخلايا للإنسولين. ولكن الفريق البحثي قرر أن يضع هذا الدواء تحت المجهر من زاوية مختلفة تماماً.
تمت معالجة جزر البنكرياس البشرية المستخرجة من المرضى بهذا الدواء، لمدة تراوحت بين 24 و48 ساعة داخل بيئة مختبرية دقيقة، بعيداً عن فوضى الجسم وضغوطه الداخلية. وكانت المفاجأة أن خلايا «بيتا» بدأت تُظهر تحسناً ملحوظاً في استجابتها للغلوكوز، وكأن هذا الدواء العريق أيقظ فيها طاقات كانت غافية.
ويحمل هذا الاكتشاف دلالة عميقة: فالأدوية التي نعرفها جيداً قد تخفي في طياتها قدرات غير مستكشفة إذا ما استُخدمت بطرق مبتكرة أو في ظروف مختلفة؛ إذ لم يعد «الميتفورمين» مجرد عقار يضبط السكر في الدم؛ بل قد يكون أيضاً أداة لإعادة تنشيط خلايا «بيتا» نفسها، في تحول يربط الماضي بالحاضر، ويمنح العلاج التقليدي دوراً جديداً في الطب المستقبلي.
بصمة جينية تكشف السر
لم يكتفِ الفريق البحثي بمراقبة مظاهر التحسن الوظيفي لخلايا «بيتا»؛ بل قرر أن يغوص أعمق داخل عالمها الخفي، ليعرف كيف ولماذا استيقظت من سباتها. فالتغيرات الظاهرة في سلوك الخلايا ما هي إلا انعكاس لتحولات دقيقة تجري في عمقها الجيني. لذلك لجأ العلماء إلى تقنيات متقدمة لتحليل البصمة الجزيئية، وهي أشبه بخريطة وراثية دقيقة، تكشف أنماط التعبير الجيني داخل الخلية لحظة بلحظة.
من خلال هذا التحليل، تمكَّن الفريق من تحديد مجموعات محددة من الجينات التي تغيِّر نشاطها بشكل واضح في أثناء مرحلة استعادة الخلايا عافيتها. وارتبط بعض هذه الجينات بمسارات الطاقة الأيضية، وأخرى بتنظيم استجابة الخلية للغلوكوز، بينما ظهرت مجموعات إضافية تتحكم في عمليات الإصلاح الذاتي وإعادة البناء الداخلي. إنها أشبه بمفاتيح كانت مغلقة لفترة طويلة، ثم فُتحت واحدة تلو الأخرى عندما وُضعت الخلايا في البيئة المناسبة.
تكمن أهمية هذه الاكتشافات في أنها لا تكتفي بشرح ما حدث؛ بل تمهد الطريق لعلاجات جديدة تستهدف هذه الجينات مباشرة. فبدلاً من الاعتماد -فقط- على تحفيز الإنسولين من الخارج، يمكن مستقبلاً تنشيط هذه المسارات الجينية من الداخل؛ سواء عبر تقنيات العلاج الجيني، أو من خلال تطوير أدوية دقيقة تُحفِّز الخلايا على التجدد الذاتي. وهي خطوة نحو الانتقال من العلاج الدوائي التقليدي إلى الطب الموجه جينياً؛ حيث يصبح فهم الجينات هو مفتاح إعادة التوازن المفقود في مرضى السكري.
أمل حقيقي وتحديات قائمة
رغم وهج النتائج التي حملتها هذه الدراسة، فإن الطريق إلى تحويلها إلى علاج فعلي لا يزال طويلاً، ويحتاج إلى مراحل متعددة من البحث والتجريب. فما تحقق حتى الآن هو إثبات لمبدأ علمي مهم، مفاده أن خلايا «بيتا» يمكن أن تستعيد جزءاً من نشاطها الأصلي إذا أُزيلت عنها العوامل الضاغطة التي كبَّلتها سنوات، وأن ما كان يُعتقد أنه تلف نهائي قد يكون في الحقيقة مجرد «تراجع مؤقت» قابل للإصلاح.
هذه الفكرة تمثل تحولاً جوهرياً في النظرة الطبية إلى داء السكري من النوع الثاني. فبدلاً من التركيز على ضبط مستويات السكر فحسب، يفتح هذا النهج الباب أمام مفهوم علاجي جديد يهدف إلى «إصلاح مصدر الخلل من الداخل»، أي إعادة الحيوية إلى خلايا «بيتا» نفسها، وهو ما قد يغيِّر مستقبل التعامل مع المرض جذرياً.
ومع ذلك، يظل التحدي الأكبر في نقل هذه النتائج من المختبر إلى جسم الإنسان؛ حيث البيئة أكثر تعقيداً وامتلاءً بعوامل الالتهاب والضغوط الأيضية التي قد تدفع الخلايا مجدداً إلى السكون. كما أن استدامة هذه «الصحوة الخلوية» على المدى الطويل لم تُختبَر بعد سريرياً، وهو ما يتطلب سنوات من العمل التجريبي والدراسات السريرية الدقيقة.
إنه أمل حقيقي، ولكنه مشروط بقدرتنا على مواجهة هذه العقبات العلمية والسريرية، وبناء جسر متين بين الفكرة والممارسة. فإذا نجح هذا الجسر، فقد نكون أمام عصر جديد من علاجات السكري، لا يقوم على إدارة المرض فحسب؛ بل على السعي الجاد لعكس مساره من جذوره.
غير أن الطريق لا يزال طويلاً؛ فالتحدي الأكبر هو تحقيق هذه الظروف داخل الجسم الحي، في بيئة مليئة بالالتهابات والضغوط الأيضية التي قد تدفع الخلايا إلى السكون من جديد.
من السكون إلى الربيع
في عمق الجسد، قد تختبئ طاقات الحياة في أماكن لا نتوقعها، تنتظر لحظة مناسبة لتستيقظ. وهكذا، تكشف هذه الدراسة أن خلايا «بيتا» التي ظنناها فقدت قدرتها إلى الأبد، لم تكن ميتة؛ بل ساكنة، تترقب بيئة أكثر رحمة لتعود إلى نبضها الأول. إنها تذكير بأن الطب ليس علم الأرقام فقط؛ بل علم الحياة وإمكاناتها الكامنة.
وكما قال جبران خليل جبران: «في قلب كل شتاء ربيع نابض، ووراء كل ليل فجر باسم». هذه الكلمات تتجسد اليوم في مختبرات العلماء؛ حيث تتحول الخلايا الخاملة إلى نوافذ مفتوحة على مستقبل علاجي جديد.
وربما يكون هذا الربيع القادم من جزر البنكرياس هو بداية فصل مختلف تماماً في رحلة الإنسان مع داء السكري، فصل يُكتب بحروف العلم ويُقرأ بلغة الأمل؛ حيث لا يُنظر إلى المرض كمصير حتمي؛ بل كقصة يمكن إعادة كتابتها من جديد.