في حادثة غريبة لم يستطع الطبيب الأميركي جيمس بريست أن يفهم حالة طفلة مريضة، إذ وبعد فحصه للحمض النووي «دي إن إيه» العائد للطفلة شديدة المرض بحثاً عن طفرة جينية تعرّضها لخطر توقّف القلب (السكتة القلبية)، تفاجأ بنتائج الفحوصات التي بدت وكأنّها تعود لطفلتين مختلفتين.
فسيفساء جينية
ونقلت وسائل إعلام أميركية عن بريست، وهو طبيب قلب متخصص بالأطفال من جامعة ستانفورد قوله: «لقد شعرت بالذهول». إذ تبيّن أنّ الطفلة تحمل مزيجاً من الخلايا المختلفة جينياً، في حالة تعرف بـ«الفسيفساء (الموزاييك) الجينية mosaicism». وكشفت الفحوصات أنّ بعض الخلايا تحمل طفرة مميتة، في حين توجد خلايا خالية من الطفرات، وكأنّها تعود لطفلة سليمة.
اعتاد الناس التفكير بأنّ خلاياهم تتشارك جينات متطابقة، منسوخة بشكل كامل منذ مرحلة تلقيح حيامن الآباء لبيوض الأمهات. ولكن عندما يتعلّق الأمر بالأطلس الوراثي (الجينوم)، وكذلك بالحمض النووي في خلايانا، إن علينا أن نتحدّث عن كلً خليّة على حدة.
وعلى مرّ العقود، اتّضح أن الجينوم لا يختلف بين شخص وآخر فحسب، بل أيضاً بين خليّة وأخرى. وهذه الحالة ليست استثنائية أو نادرة، فكلّنا عبارة عن «فسيفساء جينية».
بالنسبة للبعض، قد يعني هذا الأمر المعاناة من اضطرابات خطيرة كأمراض القلب. ولكنّ «الفسيفساء الجينية» تعني أيضاً أنّ الأشخاص الأصحاء يختلفون عن بعضهم بعضاً حتّى وأكثر ممّا تصوّر العلماء.
لغز سحري
في أوروبا القرون الوسطى، كان المسافرون الذين تمرّ طريقهم عبر الغابات يصطدمون أحياناً بشجرة غريبة، فقد كان شكل نماء بارز من جذعها يوحي وكأنّه يعود إلى نبتة مختلفة كلياً، مع تشكّل حزمة كثيفة من الأغصان، من النوع الذي يحوّله الناس عادة إلى مكانس... أغصان يدعوها الألمان «هيكسنبيسين»: مكنسة الساحرات.
في القرن التاسع عشر، وجد مربّو النباتات أنّهم إن بادروا إلى قطع غصن من أغصان مكنسة الساحرات من إحدى الشجرات وطعموها بشجرة أخرى، ستنمو هذه الأغصان المكنسة وتنتج بذوراً، تنمو بدورها لتصبح أغصان مكنسة.
وكذلك تنمو ثمار الغريب فروت الزهرية بالطريقة نفسها. إلا أن مزارعاً من فلوريدا لاحظ يوماً ظهور جذع غريب على شجرة غريب فروت من نوع «والترز»، التي تنتج عادة فواكه بيضاء اللون، ولكنّ هذا الغصن نبتت عليه ثمرات غريب فروت زهرية اللون... ومنذ ذلك الوقت، تنتج هذه البذور أشجار غريب فروت ذات ثمار زهرية.
وقد انبهر العالم تشارلز داروين بهذه الغرابة، وتعجّب من تقارير تحدّثت عن براعم غريبة وشاذّة على نباتات مزهرة، واعتقد داروين أنّها تحمل مفاتيح لحلّ ألغاز الوراثة.
طفرات متميزة
إلّا أنّ العلم لم يتمكّن حتى القرن العشرين من توضيح أنّ هذه المادّة الشديدة الأهمية هي الحمض النووي. فقد وجد العلماء أنّه بعد طفرة حدثت في خليّة واحدة، ورثت جميع سلالاتها طفرة «مكنسة الساحرات»، وأصبحت لاحقاً هذه الحالة تعرف بـ«الفسيفساء الجينية».
وقد وجد ديفيد أ. هانغرفورد وبيتر نويل أنّ الأشخاص الذين يعانون من نوع من السرطان يعرف بالـ«لوكيميا النخاعية المزمنة» يفتقرون إلى جزء كبير من الكروموسوم 22. ومن الصعب أن نفكّر بوجود عامل مشترك بين ورم خبيث وبين ثمرة غريب فروت زهرية، إلا أن كليهما نتجا عن العملية نفسها: ذرية من سلالة الخلايا التي تكتسب طفرات جديدة لا يوجد مثلها في باقي الجسم.
ثبت أيضاً أنّ «الفسيفساء الجينية» تسبب بعض الأمراض الجلدية، فقد تبيّن أنّ بعض الطفرات الجينية تتسبب في تغيّر لون جهة واحدة من الجسم إلى لون قاتم، في حين تتسبب طفرات أخرى في انتشار خطوط على البشرة.
الفرق يكمن في التوقيت. ففي حال اكتسبت خلية معيّنة طفرة في مرحلة مبكرة من النمو، فإن هذا يعني أنها ستنتج الكثير من سلالات الخلايا المشابهة التي سينتهي بها الأمر منتشرة في الجسم. أمّا الطفرات التي تظهر في وقت متأخر، فتنتج سلالة وراثية محدودة.
اضطراب جنيني
على الرغم من الانتشار الواضح لـ«الفسيفساء الجيني»، فإنه من السهل جداً عدم ملاحظتها، ومن الصعب جدّاً توثيقها.
تعرّضت إستريا لي، الطفلة التي فحصها الطبيب بريست، لسكتة قلبية يوم ولادتها. بعدها، وضع الأطباء جهازاً للصدمات الكهربائية في قلبها لاستئناف نشاطه الطبيعي.
عمل بريست على دراسة تسلسل حمض الطفلة النووي بحثاً عن سبب الاضطراب، وخلص إلى أنّها تعاني من طفرة في نسخة واحدة من جين يعرف بـ«أس سي أن 5 أيه SCN5A»، تسببت غالباً في اضطراب القلب، لأن هذا الجين هو الذي ينتج بروتيناً يساعد في تنشيط ضربات القلب.
ولكن عندما أجرى بريست اختباراً مختلفاً، لم يعثر على الطفرة. وللوصول إلى خلاصة في حلّ هذا اللغز، تعاون بريست مع ستيفن كويك، عالم الأحياء من جامعة ستانفورد كان تولّى دراسة تسلسل موروثات الخلايا الفردية. اختار بريست 36 خلية دم بيضاء من دم الطفلة، وعمل العلماء على دراسة تسلسل الموروث الجيني الكامل لكلّ خليّة.
وتبيّن أنّ النسختين من جين يعرف باسم «SCN5A» في 33 من الخلايا كانتا طبيعيتين. ولكنّ في الخلايا الثلاثة المتبقية، وجد الباحثون طفرة في واحدة من نسخ الجين... أي أنّ دم الطفلة إستريا، كان فسيفسائياً.
واتضح أيضاً أنّ لعابها وبولها يحتويان على خلايا فسيفسائية، بعضها يحمل طفرات. وأثبتت هذه النتائج أن إستريا أصيبت بهذه الفسيفسائية في مرحلة مبكرة من نموّها. وتبيّن أيضاً أنّ الخلايا في لعابها، وخلايا المثانة في بولها وخلايا الدم نشأت من طبقات مختلفة من الخلايا عندما كانت الطفلة لا تزال جنيناً في الأسبوع الثاني.
ومن المرجّح أنّ تكون طفرة «SCN5A» لدى الطفلة قد نشأت في خلية كانت موجودة قبل هذه المرحلة، لينتهي الأمر بانتشار خلايا من نسلها لاحقاً في هذه الطبقات الثلاث، وأخيراً في الأنسجة الموزعة في جسمها.
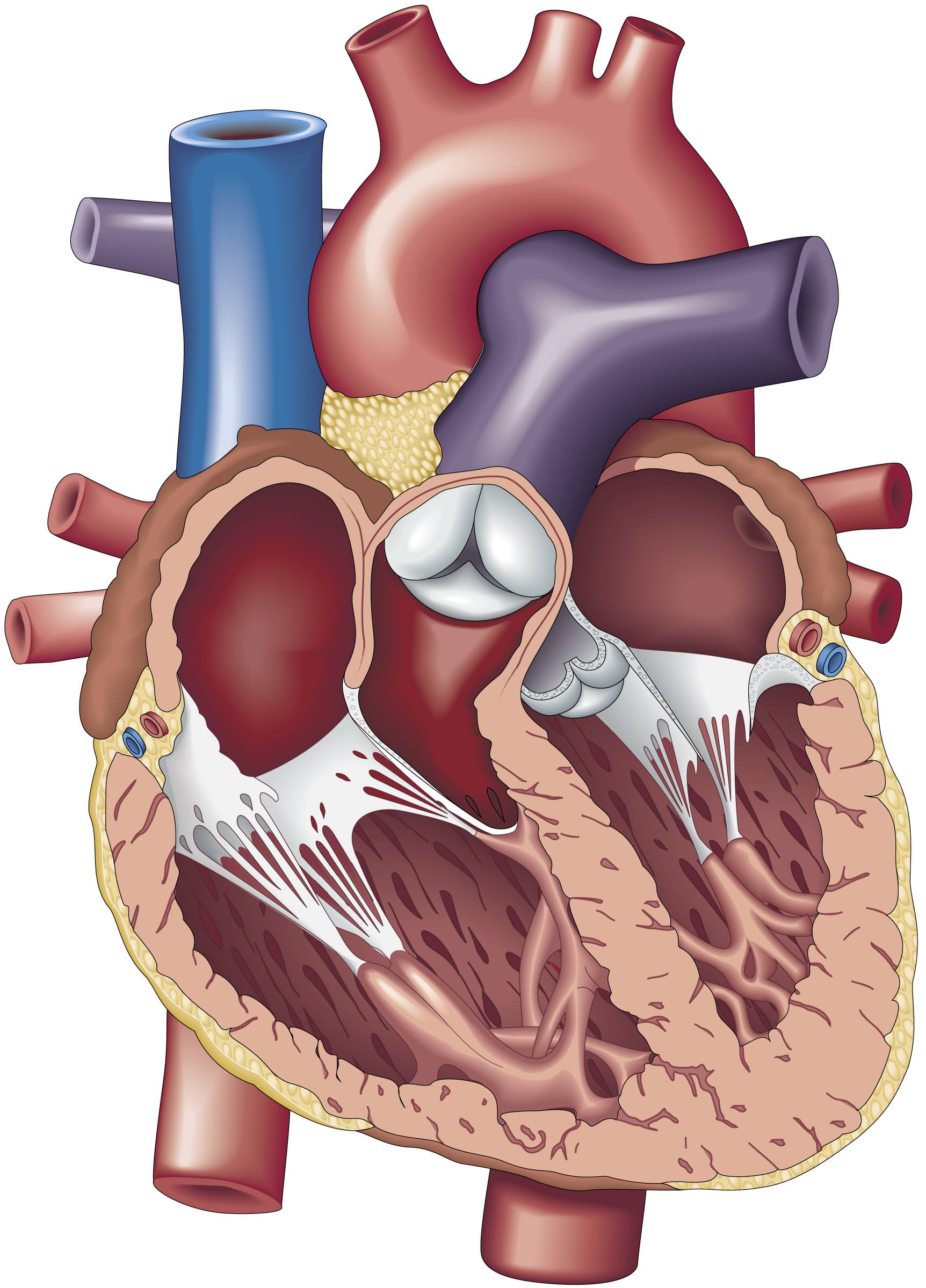
ومن الواضح جداً أن هذه الخلايا وصلت إلى قلبها أيضاً، حيث تسبّبت الطفرة نظرياً بمرض الطفلة الصغيرة.
محاكاة القلب
في الوقت الذي كان فيه بريست يعيد تركيب أصول الفسيفساء الجينية لديها، كانت إستريا تتعافى من عملية زراعة جهاز الصدمات، فاصطحبها والداها إلى المنزل، وبدت متعافية في الأشهر القليلة التي تلت. ولكن في أحد الأيام، استشعر جهاز الصدمات بضربات غير منتظمة في قلبها وأطلق صدمة، وأرسل رسالة لاسلكية للأطباء ينذرهم فيها.
بعد عودتها إلى المستشفى، اكتشف الأطباء مشكلة جديدة وهي اتساع قلبها بشكل خطير. فربط الباحثون الطفرات في جين «SCN5A» بالحالة. بعدها بوقت قصير، توقّف قلب الطفلة، فوصله الأطباء بمضخّة آلية، ريثما يتوفّر قلبُ متبرع به.
خضعت إستريا لعملية زراعة قلب وتعافت بشكل أتاح لها العودة إلى المنزل والاستمتاع بطفولة طبيعية، لتلعب مع أختها وتستمع. وعملية الزرع هذه لم تمنح إستريا فرصة جديدة للحياة فحسب، بل قدّمت لبريست فرصة نادرة للاطلاع عن قرب على فسيفساء القلب الجيني.
ثبّت جراحو الزرع بعض القطع من عضلة قلب إستريا، واستخرج بريست وزملاؤه جين «SCN5A» من الخلايا المأخوذة من أجزاء مختلفة في قلبها.
ووجد بريست وزملاؤه أنّ أكثر من 5 في المائة من الخلايا في الجهة اليمنى من القلب مصابة بالطفرة، في حين ظهرت الطفرات في 12 في المائة من خلايا الجهة اليسرى.
لدراسة تأثير الفسيفساء الجيني، طوّر بريست وزملاؤه كومبيوتراً يحاكي قلب إستريا، وبرمجوه ببذور من الخلايا المصابة بالطفرات وأطلقوه للنبض. فضرب القلب المحاكى بشكل غير منتظم، كما فعل قلب إستريا.
ويتساءل بريست عن عدد الأشخاص الذين قد يكونون معرضين لخطر مزيج الطفرات المخفية، إلا أن الباحثين لن يتمكنوا حتى الآن من معرفة الجواب، لأنهم لم يصادفوا حالة مرضية أخرى كحالة إستريا.