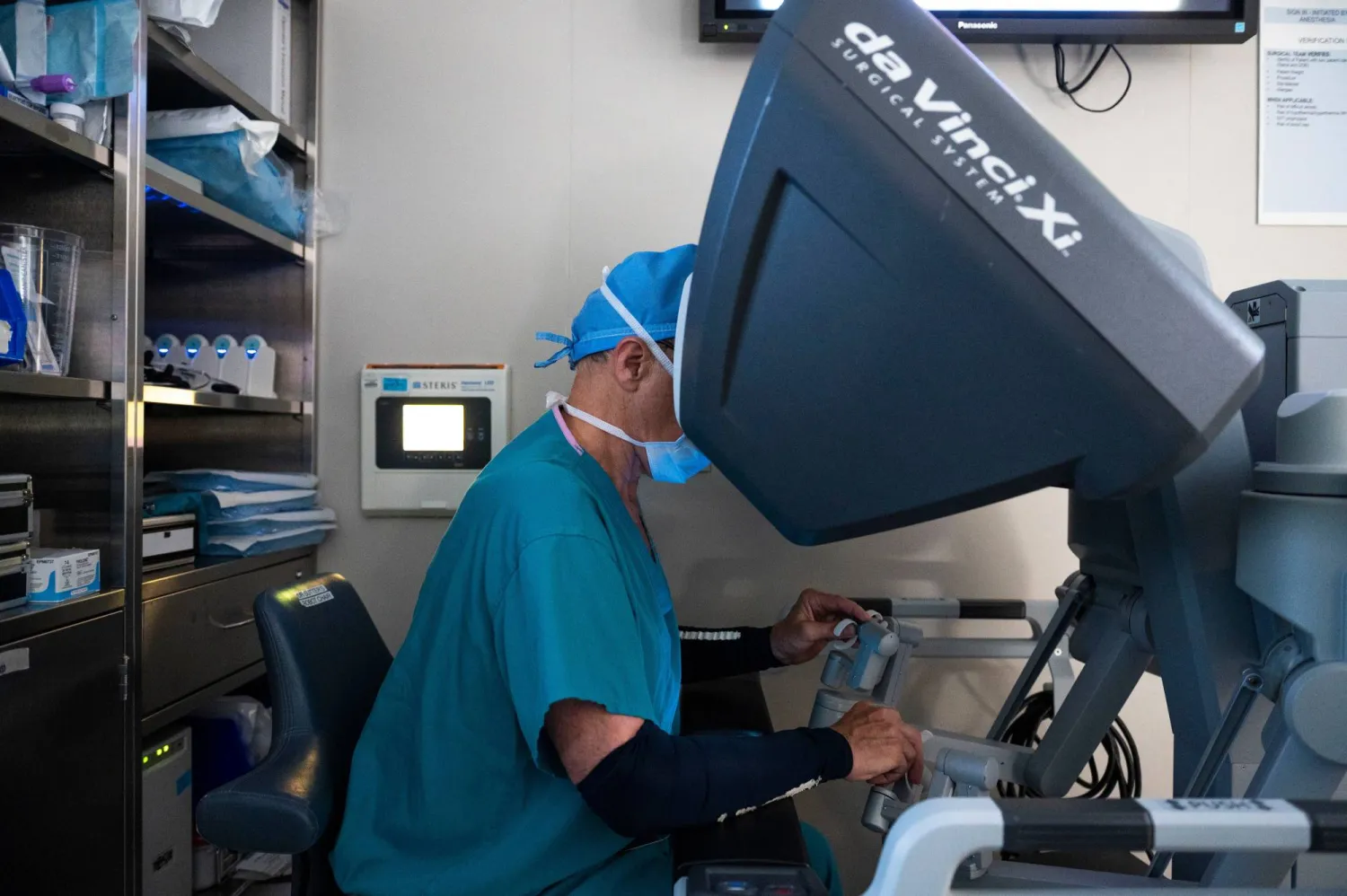
في مركز «لانكينو» الطبي، يجلس فرنسيس سوتر، جرّاح القلب والصدر من فيلادلفيا، في زاوية مظلمة بغرفة العمليات، ورأسه غارقٌ في ما تشبه خوذة واقع افتراضي كبيرة... يداه بعيدتان عن صدر المريض الذي يخضع للعملية؛ لأنّه يستخدم عصيّ تحكّم لتحريك الروبوت الذي ينفذ شق الشقوق الدقيقة بالقرب من القلب النّابض.

عمليات روبوتية
صحيح أنّ الإعدادات أشبه بألعاب الفيديو، ولكن لا توجد أي لعبة إلكترونية تنطوي على هذا الكمّ من المخاطر. يقول سوتر: «خطوةٌ واحدة خاطئة بذراع الروبوت تُحدث ثقباً في القلب».
هنا نتحدّث عن استبدال شريان جديد بآخر مسدود؛ أي ما تُعرف بـ«جراحة فتح مجرى جانبي (مجاز) للشريان التاجي»؛ جراحة القلب الأكثر شيوعاً في الولايات المتحدة. ولكنّ الوسيلة التي يستخدمها سوتر ليست شائعة، حيث تشير بيانات «جمعية جرّاحي الصدر» إلى أنّ الروبوتات كانت مسؤولة عن واحد في المائة فقط من هذه الجراحات خلال السنوات الخمس الماضية.
وشهد عام 2021 إجراء نحو 1800 عملية جراحية روبوتية فقط؛ 200 منها في مركز «لانكينو» الطبي حيث يترأّس سوتر قسم الجراحة القلبية.
أصبح مشهد الروبوتات مألوفاً في بعض الإجراءات القلبية، إلّا إنّ كثيراً من الجرّاحين يشكّكون في عدّ المساعدة الروبوتية تحسّناً في هذه العملية.
ينقل سوتر هذا الأمر للمرضى المؤهلين لهذه الجراحة؛ لأنها تقيهم عملية قلب مفتوح تتضمّن كسر عظمة الصدر وإيقاف القلب عن النبض، بالإضافة إلى ندبة على الجلد تتراوح بين 6 و8 بوصات. ويضيف أنّ مرضاه يذهبون إلى منازلهم بشقوقٍ صغيرة لا يتعدّى أكبرها البوصتين (5 سم).
يقول منتقدو هذه المنطلقات الآلية، ومن بينهم بعض الجرّاحين البارزين في فيلادلفيا، إنّ كثيراً من المرضى المؤهلين لهذه الجراحة يحتاجون لفتح أكثر من مجرى، وهذا الأمر غالباً غير ممكن بتقنية سوتر، فضلاً عن أنّ الروبوت قد يرفع تكلفة الجراحة.
يسمع سوتر كثيراً من النقد، ولكنّه لا يزال يأمل أنّ تساعد أبحاثه في تشجيع مزيد من الجراحين على الاستفادة من الإجراء الآلي الذي يجريه منذ أكثر من عقدين.
مسار تعليمي وتجريبي
بدأ سوتر عام 1986 إجراء جراحة فتح مجرى جانبي للشريان التاجي باستخدام المقاربة المعيارية التي يعدّها عنيفة وخطرة. ولهذا السبب أبدى اهتماماً فورياً عندما سمع أنّ بعض الجراحين حول العالم بدأوا استخدام روبوت لهذا الإجراء في أواخر التسعينات.
وقد رأى أداةً سمحت بإجراء جراحة في قلبٍ نابض وجنّبت الأطباء تلك اللحظة المرعبة التي يصلّون فيها إلى عودة القلب إلى العمل من جديد. اعتقد سوتر أنّ الجراحة الروبوتية قد تساعد في تقليص وقت التعافي وتتيح له إجراء العملية لمرضى لا يحتملون العملية التقليدية.
بدأ الجرّاح أداء هذه العملية قبل 18 عاماً، ولا يزال حتّى اليوم يُذهَل عندما يرى مرضاه جالسين في السرير بعد بضع ساعات فقط.
إجراء متخصص
يستخدم سوتر روبوتاً لتصحيح الانسداد في الشريان الأكبر الذي يغذّي الدم في عضلة القلب في جراحة من جزأين تتطلّب نحو 4 ساعات.
أولاً: يستخدم الجرّاح الروبوت لـ«حصاد» الشريان الثديي الداخلي الشمالي؛ الخيار العملي لاستبدال الشريان المتضرّر في كثير من هذه الجراحات. يضع الروبوت قفازاً معقّماً ويخيط الشريان «البديل» في القلب، ليسمح لتدفّق الدمّ بتخطّي الانسداد. تحتاج هذه الخطوة الشقّ الأكبر خلال الجراحة الذي لا يتعدّى طوله البوصتين.
في الماضي، كان سوتر يستطيع إجراء العملية الكاملة باستخدام الروبوت، ولكنّ الشركة المصنّعة للأخير توقّفت عن صناعة أداة حيويّة للجراحة بسبب انخفاض الطلب.
وقال سوتر إنّه يصحّح جراحياً شرياناً واحداً لدى 80 في المائة من مرضاه. ولأنّ الناس يعانون غالباً من انسدادٍ في الأوعية أكثر؛ يتزوّد كثير من مرضاه بدعامات، وهي جهاز يشبه النابض يُزرع بواسطة قسطرة، في أوعية أخرى. يفضّل الجرّاح هذا الإجراء على فتح الصدر وأداء إجراءات عدّة لفتح جانبي في الحالات التي تسمح بذلك.
جدل طبي حول توظيف الروبوت الجراحي
تلاحق المستشفيات عادةً العلاجات الأكثر تطوّراً، حتّى عندما لا تحصل التكلفة على الدعم البحثي الكامل. ولكنّ جرّاحي القلب في فيلادلفيا لا يتّبعون وسيلة سوتر الآلية.
ويقول روهينتون موريس، رئيس قسم الجراحة القلبية في «مستشفى جيفرسون الجامعي»، إنّ «جرّاحي القلب المهرة كثُر، ويوجد سببٌ لعدم اعتمادهم هذه الوسيلة». ويضيف أنّ القلق من استخدام آلة القلب - الرئة عفى عليه الزمن، وأنّ نحو 90 في المائة من جراحات فتح مجرى جانبي للشريان التاجي في «جيفرسون» تُجرى على قلب متوقّف ومن دون استخدام روبوت.
لا يستخدم مستشفى «تيمبل» الجامعي بدوره الروبوت لإجراء هذه العملية، وفق يوشيا تويودا، رئيس قسم جراحة القلب والأوعية؛ لأنّ أكثر ما يخشاه هو محدودية التقنية الروبوتية لجهة عدد الشرايين التي يستطيع الجرّاح تصحيحها. ويصلح تويودا عادةً 4 شرايين في العملية الواحدة، ويصل العدد أحياناً إلى 8.
ويتساءل تويودا: «حزّ أفضل في الجلد أم إعادة تكوين كاملة للأوعية؛ أيّهما أفضل؟ أعتقد أنّ المريض سيستفيد من الثانية».
يستخدم المستشفى التّابع لجامعة بنسلفانيا و«مركز بريسبيتاريان الطبي» التابع للجامعة الروبوت في 10 في المائة من مجمل 550 جراحة فتح مجرى جانبي للشريان التاجي سنوياً في المنشأتين، وفق ما كشف عنه متحدّث باسم الجامعة.
يشعر الجرّاحون بالقلق أيضاً من التكلفة، حيث يصل سعر الروبوت وحده إلى مليوني دولار، فضلاً عن تكلفة تدريب الجرّاحين ليصبحوا بمهارة سوتر.
رأس تي سلون غاي فريق الجراحة الروبوتية في «جمعية جرّاحي الصدر» لسنوات، وهو مختصٌّ في إصلاح الصمام التاجي ويستخدم الطريقة الآلية في 98 في المائة من الحالات. ولكن عندما يجري جراحة فتح مجرى جانبي للشريان التاجي، يقوم بها بالطريقة التقليدية. وعدّ غاي أنّ الإجراء الذي يستخدمه سوتر «هو نوعٌ مخصص لنخبة النخبة الذين يكرّسون أنفسهم له».
ولكنّ غاي، الذي تدرّب وعمل في فيلادلفيا، متفائل جداً بمستقبل جراحات القلب الروبوتية، ويعتقد أنّ تحسّن هذه التقنية سيحوّلها إلى معيار بسبب ارتفاع طلب الناس عليها. ويلفت إلى أنّ «التعافي السريع والتدخّل الجراحي الطفيف مهمّان بالنسبة للمرضى».
بيانات واعدة
يدرك سوتر أنّ المسار الحالي ينعكس سلباً على عمليات فتح مجاري الشرايين الروبوتية. ولكنّه يعتقد أنّ الجراحة يجب أن تكون خيار المريض المستفيد.
في آخر مؤتمرات «جمعية جرّاحي الصدر»، قدّم أحد طلّاب سوتر، وهو الجرّاح ألكساندر دوكولاري، تحليلاً أولياً لنحو 2400 جراحة روبوتية لفتح مجرى شريان جانبي أجريت في مركز «لانكينو»، وتبيّن أنّ النتائج واعدة.
ووجدت دراسات أخرى أجريت خارج مركز «لانكينو» أيضاً أنّ الإجراء الآلي آمن ورجّحت نتائج إيجابية. ولكنّ لا توجد حتّى اليوم دراسة اعتمدت تجربة عشوائية منتظمة، التي تعدّ المعيار الذهبي في مجال البحث الطبي، لتقييم التقنية الروبوتية في مواجهة الجراحة التقليدية.
في الوقت الحالي، يبدو سوتر مقتنعاً بأنّه في المكان المناسب، في غرفة عملياته، ينظر إلى شاشة تستعرض القلب بالأبعاد الثلاثية وبمقاس أكبر بعشر مرّات، بينما تجري الذراع الروبوتية الجراحة على مسافة أمتار قليلة منه.
* «ذا فيلادلفيا إنكويرير»
- خدمات «تريبيون ميديا»